nCOV – Ce qu’il faut retenir de cette épidémie
Traduction du tweetoriel disponible sur le site internet du CCDD (traduction de l’acronyme CCDD : Centre d’étude des Dynamiques des Maladies Transmissibles).
Nous en apprenons chaque jour plus sur l’épidémie #nCOV2019.
Voici 5 questions et terminologies clés couramment utilisées en épidémiologie des maladies infectieuses, pour faciliter la compréhension des informations qui circulent concernant cette épidémie – adapté d’un #tweetoriel réalisé par l’étudiante en thèse Rebecca Kahn (@rebeccajk13 – profil en anglais).
Des traductions sont aussi disponibles en Coréen, Mandarin et Espagnol.
- R0 – Que signifie cet indicateur et à quoi sert-il ?
- R0 – qui se prononce « R zéro » et est appelé « Taux de reproduction de base », est un nombre qui décrit la contagiosité du pathogène.
- R0 est le nombre de personnes, en moyenne, qui seront infectées à partir d’un cas (i.e. personne infectée) introduit dans une population dont tous les individus sont susceptibles à l’infection. Un R0 supérieur à 1 signifie que chaque personne infectée transmettra l’infection à plus d’une autre personne, ce qui peut engendrer une épidémie.
- R0 ne fournit aucune information sur le nombre total de personnes infectées à un moment donné. Il n’est pas non plus une mesure de la sévérité de la maladie infectieuse en question –il n’indique que le nombre de personnes qu’une personne infectée peut infecter à son tour, mais ne donne aucune information sur la sévérité des infections ainsi engendrées.
- R0 n’est pas nécessairement constant pour une maladie donnée et peut dépendre de divers facteurs comme la densité de la population étudiée ou les types de contacts entre les individus composant ladite population. Malgré cela, il reste relativement similaire d’une population à une autre pour une maladie donnée.
- Il existe diverses manières d’estimer R0. Au début d’une épidémie, le nombre de cas rapportés augmente de manière exponentielle, et R0 équivaut approximativement à 1 + taux de croissance des cas rapportés * intervalle intergénérationnel (temps de propagation d’une infection à la suivante).
- Pour plus de précisions et de détails sur la méthode de calcul, voir https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1766383/ (publication en anglais).
- En utilisant cette approche, le CDC (Center for Disease Control – Centre de Contrôle des Maladies) de Guangdong a estimé le R0 pour l’épidémie de nCoV2019 à 2,9 : https://www.biorxiv.org/content/10.1101/2020.01.25.919787v1 (Preprint en anglais)
- Les freins à cette approche de calcul sont les suivants :
- Les cas sont déclarés de manière incomplète (certains ne sont donc pas pris en compte), ce qui peut engendrer des biais (sur- ou sous-estimation) dans le calcul de R0, notamment en cas de changements dans la proportion des cas détectés ou de retards dans la déclaration des cas.
- L’intervalle intergénérationnel est incertain, ce qui impacte directement le calcul de R0, puisqu’il s’agit de l’intervalle de temps sur lequel il est estimé.
- Dans le cadre de modélisations mathématiques simples, il est possible de calculer R0 comme résultant du produit : probabilité d’être infecté sachant que l’individu a eu un contact avec une personne infectée (b) * taux de contact entre personnes (k) * durée de l’infection (d). Au début d’une épidémie, les données disponibles étant limitées, ces différents paramètres sont difficiles à estimer.
- Le nombre/taux de contact (k) est particulièrement difficile à estimer. Cette valeur peut être très hétérogène d’une situation à une autre, ce qui peut se traduire par des « explosions » du nombre de cas à partir de « super-spreaders ». Un « super-spreader » est une personne dont le nombre de contacts avec d’autres individus est élevé, ce qui signifie qu’elle peut en infecter un grand nombre. L’existence de « super-spreaders » génère de l’hétérogénéité dans la valeur de R0 et a joué un rôle important au cours des épidémies de SRAS et MERS.
- R0 a été estimé de différentes manières à l’aide d’approches variées : https://docs.google.com/spreadsheets/d/1QP5vM62ctnMRYdkQ4J5IqaOmB3hISGvYqCvnB8rBmNY/edit#gid=0 (GoogleDoc de comparaison des différents modes de calcul de R0 pour l’épidémie de nCOV2019 – en anglais). Attention, toutes les estimations ne se valent pas.
- Par exemple, il est préférable d’utiliser le taux de croissance du nombre de cas basé sur la date de début des symptômes plutôt que sur la date de déclaration des cas, parce que ces déclarations peuvent être transmises avec divers délais, fournir des informations incomplètes sur un certain nombre de cas rapportés en même temps, ou comporter d’autres zones d’ombre. Les dates de début des symptômes ont aussi leurs propres biais, mais il reste plus prudent de les utiliser.
- Par ailleurs, si les cas d’infection en cours n’ont pas encore tous été répertoriés, le taux de croissance basé sur la date de début des symptômes peut sembler plus faible au moment présent, comparé aux jours antérieurs. Il est nécessaire de prendre cette tendance à la baisse en compte dans les estimations de R0 afin de ne pas la considérer, à tort, comme une baisse de la transmission.
- Un exemple de l’épidémie de grippe de 2009 :
https://onlinelibrary.wiley.com/doi/full/10.1111/j.1750-2659.2009.00106.x (article en anglais)
- R0 – qui se prononce « R zéro » et est appelé « Taux de reproduction de base », est un nombre qui décrit la contagiosité du pathogène.
- Comment estimer de manière fiable le nombre de cas de nCoV ?
- Les rapports publiés par les infrastructures de santé et les agences gouvernementales sont des sources d’information clés. Cependant, au début d’une épidémie, le nombre total de cas reste incertain, et ce malgré le fait que le nombre de cas diagnostiqués est rapidement rapporté (comme dans le cas du nCoV).
- Si l’on part du principe que de nombreux cas ne sont pas détectés au niveau de l’épicentre de l’épidémie (Wuhan dans le cas de l’épidémie de nCoV) mais que près de 100% des cas sont répertoriés chez les personnes effectuant des voyages internationaux, l’incidence des cas chez les voyageurs, combinée à la probabilité quotidienne de voyager et au temps moyen de détection de l’infection peuvent être utilisés pour estimer le nombre total de cas à l’épicentre.
- Cette approche a été utilisée pour l’épidémie de nCoV :
https://www.imperial.ac.uk/mrc-global-infectious-disease-analysis/news–wuhan-coronavirus/ (informations en diverses langues, dont le français). - Des méthodes similaires ont été utilisées lors de l’épidémie de H1N1 de 2009. Voir cet article en anglais pour plus de précisions :
https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0006895 - Des membres de l’Université de Hong Kong (abrégée HKU en anglais) ont publié des résultats de leurs prévisions immédiates (nowcast en anglais) ou à plus long terme (forecast en anglais), en utilisant le nombre de cas confirmés et des estimations du nombre de voyages journaliers : https://sph.hku.hk/images/news/press-releases2020/Wuhan-20200127.pdf (publication en anglais).
- Cette autre analyse combine une approche basée sur le volume de voyageurs quittant Wuhan et le nombre de cas exportés pour estimer le nombre de cas à Wuhan. Une fois ce nombre obtenu, le volume de voyageurs quittant la ville est de nouveau utilisé pour estimer le nombre de cas exportés dans d’autres villes de Chine : https://files.sph.hku.hk/download/wuhan_exportation_preprint.pdf (Preprint en anglais).
- La surveillance active, qui implique d’effectuer des tests sur un échantillon (idéalement représentatif) de la population présentant des symptômes, peut aussi être utilisé pour estimer le nombre total de cas :
https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(09)61377-5/
(article en anglais).
- Les rapports publiés par les infrastructures de santé et les agences gouvernementales sont des sources d’information clés. Cependant, au début d’une épidémie, le nombre total de cas reste incertain, et ce malgré le fait que le nombre de cas diagnostiqués est rapidement rapporté (comme dans le cas du nCoV).
- Comment et quand épidémie de nCoV a-t-elle commencé ?
- Le séquençage rapide du génome d’un virus peut fournir des informations sur le moment auquel le virus a été introduit dans une population, si le virus a été introduit de multiples fois dans ladite population, et l’origine des infections importées. Les virus mutent, donc si deux personnes se trouvent être infectées par des virus similaires, cela suggère que leurs infections sont liées.
- En combinant l’analyse des génomes viraux obtenus à partir de personnes infectées avec des estimations du taux de mutation de ces virus et du nombre total de cas, il devient possible d’estimer à quel moment le virus a été introduit dans une population.
- Les analyses des virus nCoV suggèrent que le virus a été introduit en Novembre-Décembre 2019.
- La similarité entre les virus laisse à penser que le virus n’a été introduit qu’une ou peu de fois à partir d’animaux : http://virological.org/t/phylodynamic-analysis-of-ncov-2019-genomes-29-jan-2020/353 (forum en anglais) et https://nextstrain.org/ (site internet en anglais).
- Combinées avec des données sur l’exposition et l’histoire des déplacements des personnes, les données génomiques peuvent permettre de distinguer les cas importés de ceux transmis localement. La plupart des cas répertoriés en dehors de Chine ont été importés, mais une transmission locale commence à être rapportée : https://systems.jhu.edu/ (site de suivi des cas de nCoV dans le monde – en anglais).
- Comment peut-on contenir une epidémie ? Qu’est-ce qui peut impacter ces mesures de confinement ?
- Re, le « taux de reproduction effectif », est le nombre de personnes infectées par un seul cas lorsque la population n’est pas entièrement sensible et/ou lorsque des mesures de contrôle sont en place.
- Re = R0*(1 – effet des mesures de contrôle)*(proportion de la population qui est toujours sensible à l’infection)
- Pour arrêter une épidémie, il faut rendre Re inférieur à 1.
- Les vaccins sont l’un des meilleurs outils disponibles pour rendre Re inférieur à 1, car ils permettent de réduire la proportion de la population qui est toujours sensible à l’infection. Un peu comme dans un feu de forêt, si le nombre d’individus (arbres) sensibles est fortement réduit, l’épidémie (le feu) s’éteint.
-
- Le développement de vaccins pour nCoV2019 est en cours :
https://cepi.net/news_cepi/cepi-to-fund-three-programmes-to-develop-vaccines-against-the-novel-coronavirus-ncov-2019/ – site internet en anglais
- Le développement de vaccins pour nCoV2019 est en cours :
-
- Traiter l’infection peut également réduire Re en réduisant la durée de l’infection (et, par extension, la période de temps pendant laquelle une personne infectée est infectieuse donc capable de transmettre l’infection). Tant que des vaccins et traitements ne sont pas disponibles, il est nécessaire d’utiliser des modes d’interventions non-pharmaceutiques. Cela inclut des mesures de réduction du nombre de contacts, comme le suivi de l’apparition des symptômes suivi d’une période d’isolation si les symptômes se déclarent, ou la quarantaine.
- L’efficacité relative de ces interventions basées sur les cas rapportés (ce qui requiert donc de savoir qui est infecté) dépend de deux facteurs clés :
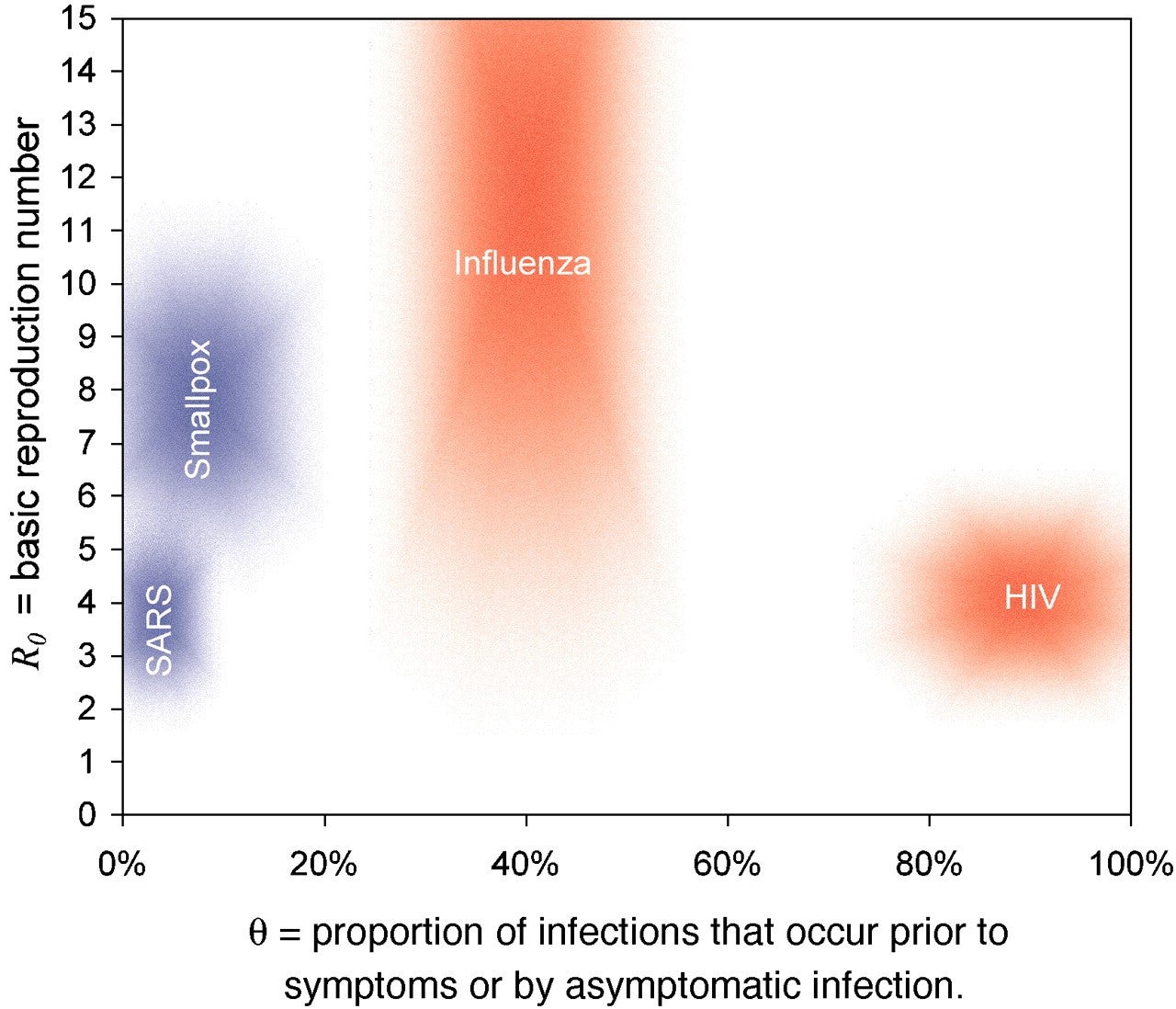
- 1. Le lien entre le moment où une personne infectée devient infectieuse et le moment où les symptômes apparaissent
- 2. La proportion d’infections pré-symptomatiques et asymptomatiques : https://www.pnas.org/content/101/16/6146.full (article en anglais)
- Si l’infection est telle qu’un cas est infectieux avant l’apparition de symptômes ou en l’absence de symptômes, le contrôle de l’épidémie est particulièrement difficile. En effet, de nombreux cas pourraient ne pas être détectés avant transmission de l’infection, ou pourraient ne jamais être détectés bien que toujours capables de transmettre l’infection.
- La mise en quarantaine peut réduire les risques évoqués ci-dessus mais a un coût en matière de faisabilité et de libertés sociales :
https://www.pnas.org/content/pnas/114/15/4023.full.pdf (article en anglais)
- La mise en quarantaine peut réduire les risques évoqués ci-dessus mais a un coût en matière de faisabilité et de libertés sociales :
- Re, le « taux de reproduction effectif », est le nombre de personnes infectées par un seul cas lorsque la population n’est pas entièrement sensible et/ou lorsque des mesures de contrôle sont en place.
- Si la transmission commence avant le début des symptômes, comme cela a été évoqué de manière quelque peu inquiétante dans certains médias ( https://www.bbc.com/news/world-asia-china-51254523 – article en anglais), contrôler l’épidémie par isolation sera plus difficile.
- Il n’y a aucune donnée à l’heure actuelle sur la fréquence de la transmission pré-symptomatique avec le nCoV.
- Une autre manière de contrôler les épidémies est d’examiner les voyageurs aux points d’entrée – d’une agglomération, d’un pays – afin de détecter des symptômes potentiels de la maladie.
- En revanche, en cas de transmission pré-symptomatique (avant la déclaration des symptômes) ou asymptomatique (sans qu’aucun symptôme ne soit visible), cette approche est moins efficace.

- En revanche, en cas de transmission pré-symptomatique (avant la déclaration des symptômes) ou asymptomatique (sans qu’aucun symptôme ne soit visible), cette approche est moins efficace.
- Sévérité – une arme à double tranchants
- Comprendre les manifestations cliniques d’une infection due à un nouveau pathogène est primordial pour adapter les mesures de santé publique mises en place contre une épidémie.
- Les cas d’infection sévères, lorsqu’ils entraînent l’hospitalisation ou la mort des personnes touchées, ont plus de chance d’être détectés et répertoriés.
- Les individus infectés présentant peu ou pas de symptômes ont plus de chance de ne pas être détectés. Si ces individus contribuent à la transmission de la maladie, l’épidémie est plus difficile à contrôler.
- D’un autre côté, si les cas bénins ou asymptomatiques sont courants et qu’ils ne contribuent PAS beaucoup à la transmission, cela facilitera le contrôle de l’épidémie, car un nombre réduit d’individus nécessiteront des soins et leurs infections auront plus de chance de leur permettre de développer une certaine immunité contre les réinfections, du moins pour un certain temps.
